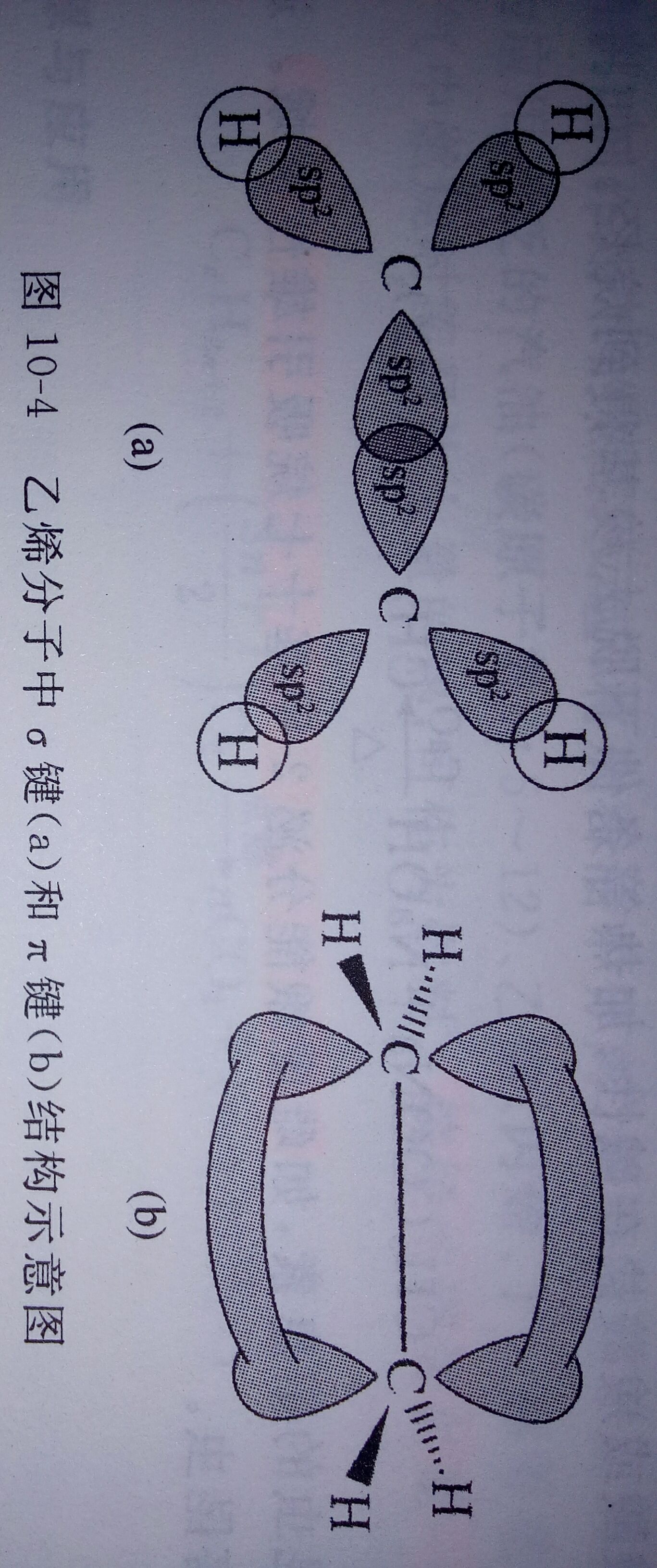
σ键局正指的是原子轨道沿着键轴方向通过“头碰头”式重叠形成的共价键。s轨道成球形,任何方向成键都是头碰头,因此只形成σ键。已经形成σ键后,两个原子间才可能形成π键。形成一个π键则与σ键并称为双键。在烯烃中形成双键的两个碳原子采取sp2杂化,共六个杂化轨道,在缺含两个碳原子及它们相邻的四个原子间共形成五个σ键,键角均为120°,六个原子处于同一平面,两个碳原子中各有一个未参与杂化的原子轨道,它们垂直于该平面并相互平行,通过肩并肩重叠形成伏腊笑π键,π键位于平面的两侧,阻止了碳原子绕σ键轴的旋转,导致烯烃出现顺反异构。
标签:碳碳,cigema,sp2
版权声明:文章由 知识百答 整理收集,来源于互联网或者用户投稿,如有侵权,请联系我们,我们会立即处理。如转载请保留本文链接:https://www.zhshbaida.com/life/248492.html




















![跪求[爱很烂蓝光中字收藏][手机电影下载就上种子下载,好人一生平安](/upload/images/2023/0925/19c47421.jpg)
